ChIP作为表观遗传学最重要的研究技术之一,也是目前唯一一项可以研究体内蛋白质与基因相互作用关系的技术,因此,这也是为什么做CHIP分析出来的结果更为可信的原因之一,因为它能更加真实完整地反映结合在DNA序列上的调控蛋白,是目前确定与特定蛋白结合的基因组区域或确定与特定基因组区域结合的蛋白质的最好方法。
ChIP实验原理
ChIP,全称的意思是染色质免疫共沉淀——简单来说,就是我们用抗体去“钓”特定的能结合DNA的蛋白质,我们最后检测的是和这蛋白质结合的DNA。
DNA不是漂浮在细胞核里的毛线团,而是和组蛋白结合的,被卷起来,被安排的好好的。
组蛋白一般由8个亚基组成,4种,每种2个。其中H3亚基上如果有乙酰化修饰,这个组蛋白上缠着的DNA很可能就是“活跃”的,因此CHIP实验的正对照就是使用乙酰化H3的抗体来做共沉淀。
ChIP实验流程
目前广泛使用的ChIP实验试剂盒,通常需要2-3天的时间完成一次完整的实验,简易流程如下:
第一天:
甲醛固定细胞→收集细胞,超声破碎或酶解法破碎细胞→加入目的蛋白的抗体,与超声后的靶蛋白-DNA复合物相互结合,过夜孵育;
第二~三天:
加入Protein A Agarose,结合抗体-靶蛋白-DNA复合物,并沉淀→对沉淀下来的复合物进行清洗,除去一些非特异性结合→洗脱,得到富集的靶蛋白-DNA复合物→解交联→纯化富集的DNA-片断→qPCR分析。在qPCR分析这一块,比较传统的做法是半定量-PCR。但是现在随着荧光定量PCR的普及,使用qPCR更能定量地反映实验结果。
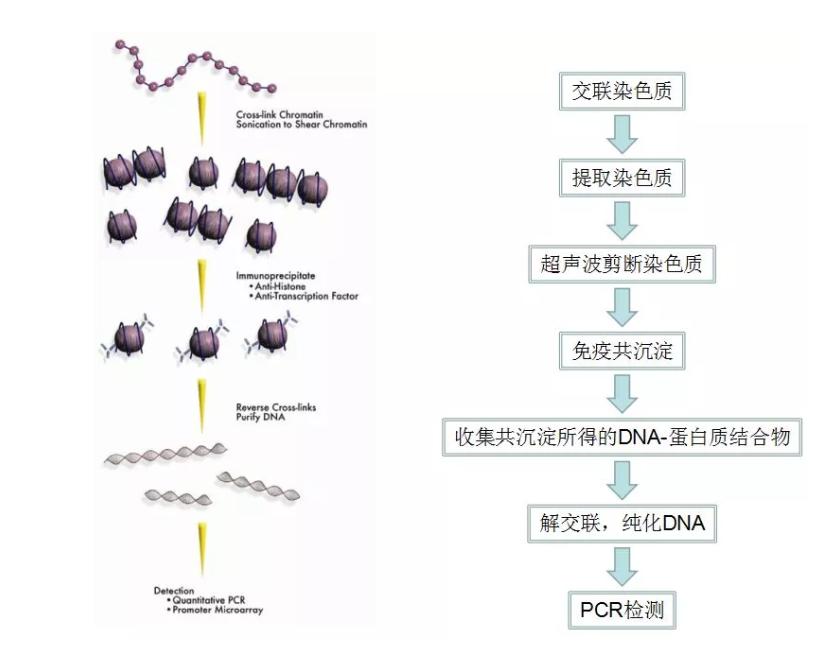
ChIP实验重点注意事项
交联染色质
DNA-蛋白质的结合并不是非常牢固,为了实验的效果更好,一般通过添加甲醛让DNA和蛋白质交联,让两者结合的更加牢固。但是甲醛有很强的让蛋白质变性的能力,所以需要控制甲醛的用量。
实际应用中,是通过直接向细胞培养液中加入甲醛溶液,达到培养液中甲醛含量1%时为适宜,所以培养细胞的培养液的量在实验前需要弄清楚。
另外,交联步骤过后,需要用细胞刮收集细胞,所以请尽量把细胞培养到一个容器里交出来做CHIP实验。
超声波剪断染色质
在进行免疫共沉淀之前,需要把染色质破碎到大部分碎片上DNA长度在200~1000个碱基对。
在这一步,我的改进是用较低的超声破碎仪功率,设置时间梯度,来筛选比较好的破碎程序。
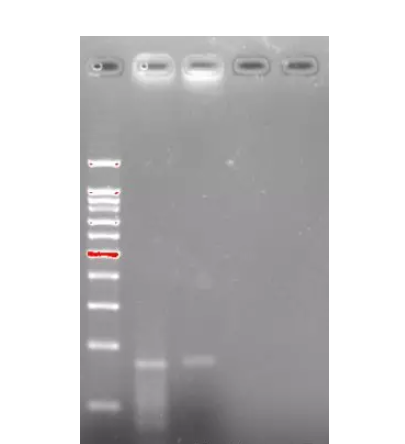
左图第一泳道是marker,第二泳道是总染色质,第三至第六泳道依次是破碎30s到120s,可见破碎120s效果最好。
CHIP实验正对照
CHIP实验正对照有两个方面:免疫共沉淀使用乙酰化H3的抗体;PCR检测使用GAPDH启动子对应的引物,目的片段长度为167bp。
上图第一泳道是marker,第二泳道是input的PCR结果,第三泳道是CHIP实验正对照。
根据指标设计CHIP引物
CHIP实验一般瞄准的是基因的启动子区域,这一部分相对于基因翻译区,信息要模糊的多,可以通过NCBI上的gene browser来辅助分析,一般可以在转录起始区域上游100~1000bp选择。但是还是需要至少设计两组引物,从中选择效果较好的。
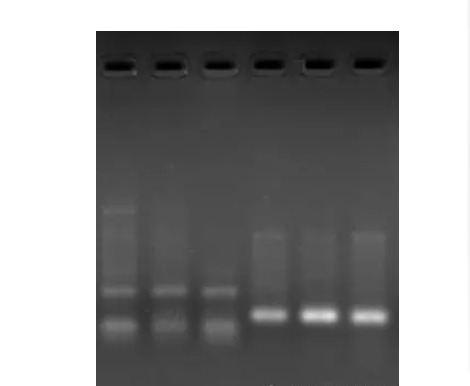
如左图所示,前三个泳道和后三个泳道是同一个基因启动子的不同引物,效果上有明显差距。

