
迄今为止,尚未报道通过单一纳米药物同时靶向肿瘤微环境和癌细胞。在这里,本研究报告了零价铁纳米颗粒 (ZVI-NP) 的双重特性,可诱导癌症特异性细胞毒性和抗癌免疫。
方法与结果:
本研究通过在免疫活性小鼠和人源化小鼠中评估了ZVI-NP的治疗潜力。 ZVI-NP引起线粒体功能障碍、细胞内氧化应激和脂质过氧化,导致肺癌细胞铁死亡(见图一、图三)。GSK3/β-TrCP通过AMPK/mTOR激活对NRF2的降解在这种癌症特异性铁死亡中得到增强(见图四、五)。此外,ZVI-NP减弱了癌症的自我更新能力并下调了血管生成相关基因(见图二)。重要的是,ZVI-NP通过将促肿瘤M2巨噬细胞转变为抗肿瘤M1、减少调节性T细胞的数量、下调 CD8+T细胞中的PD-1和CTLA4以增强它们对癌细胞的细胞溶解活性来增强抗肿瘤免疫力(见图六), 同时在体外减弱癌细胞中的PD-L1表达和在荷瘤免疫活性小鼠中。特别是,ZVI-NPs优先在肿瘤和肺组织中积累,从而显着抑制肿瘤的生长和转移(见图七)。
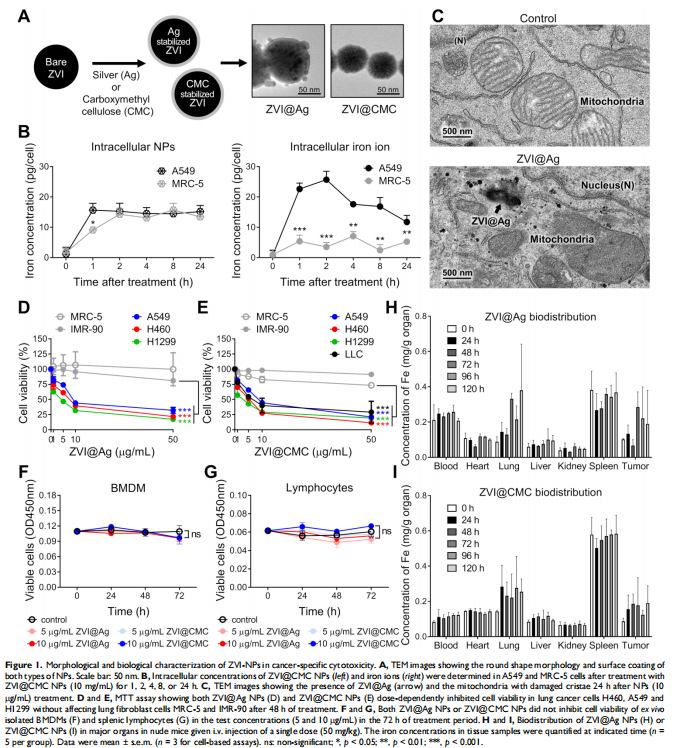
<图1>
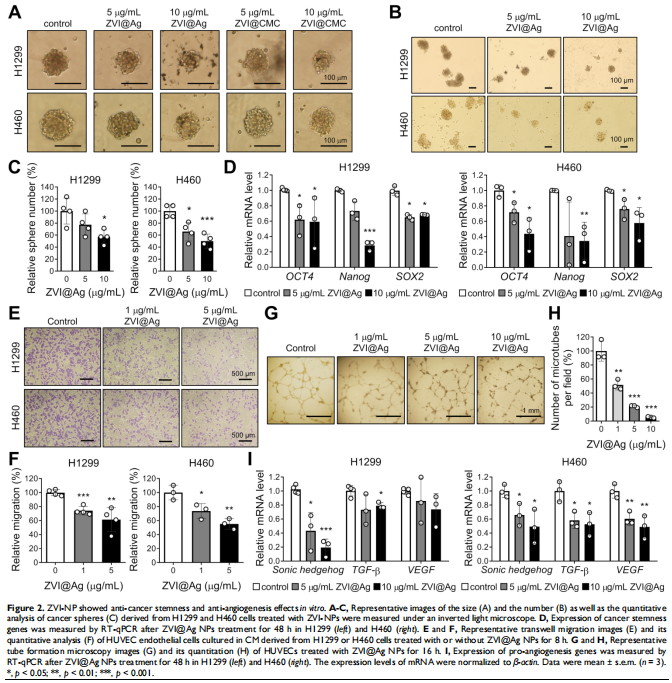
<图2>
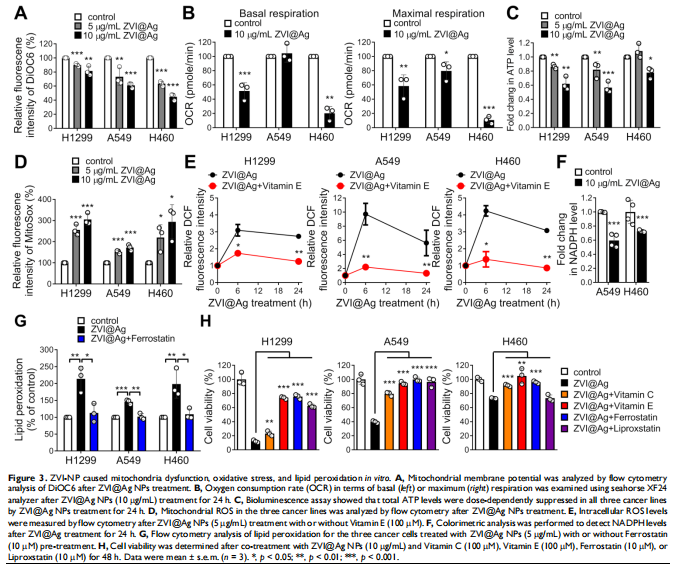
<图3>
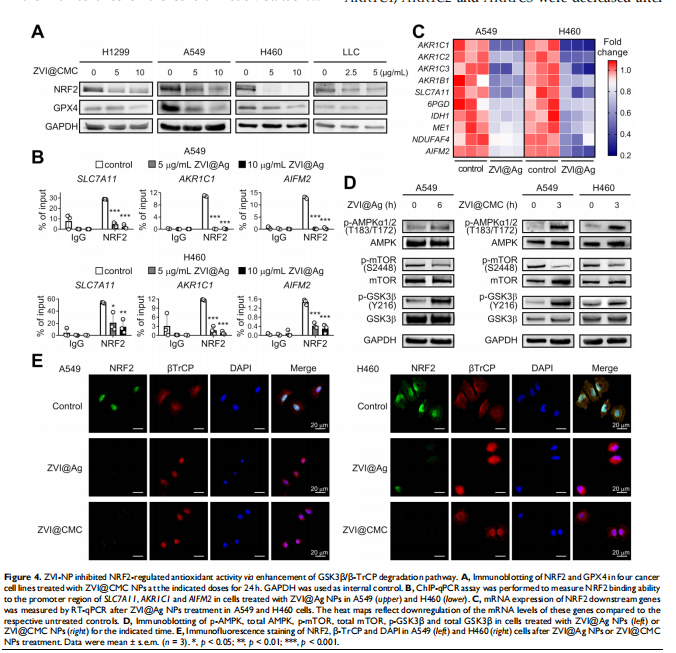
<图4>
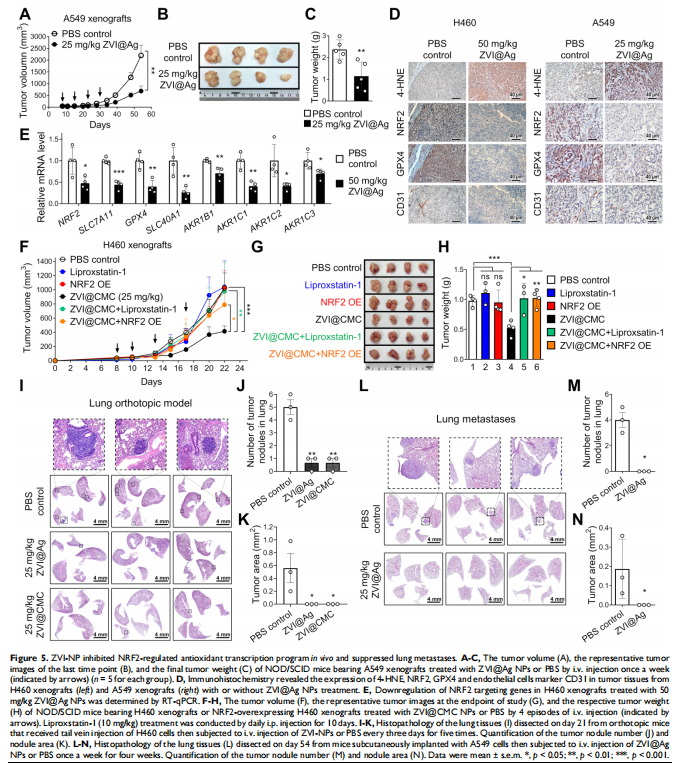
<图5>
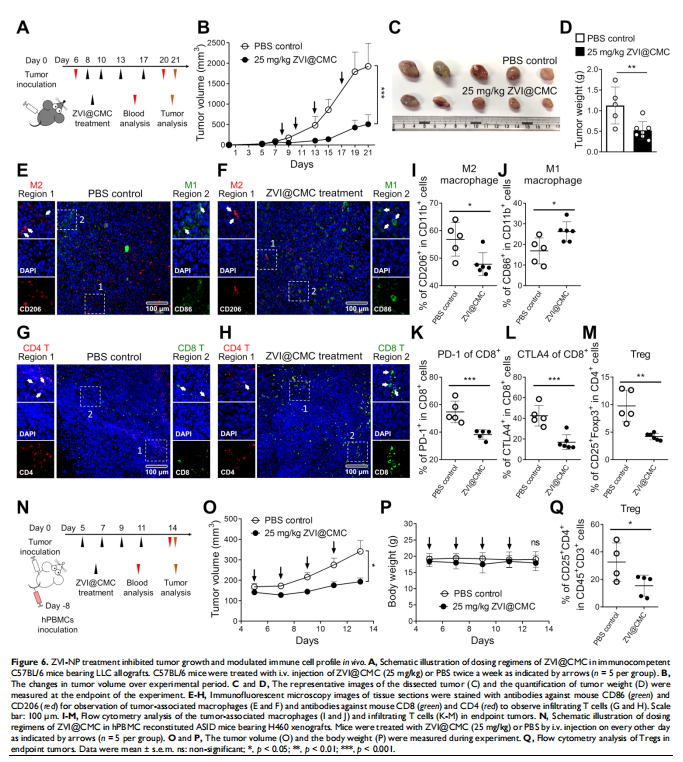
<图6>
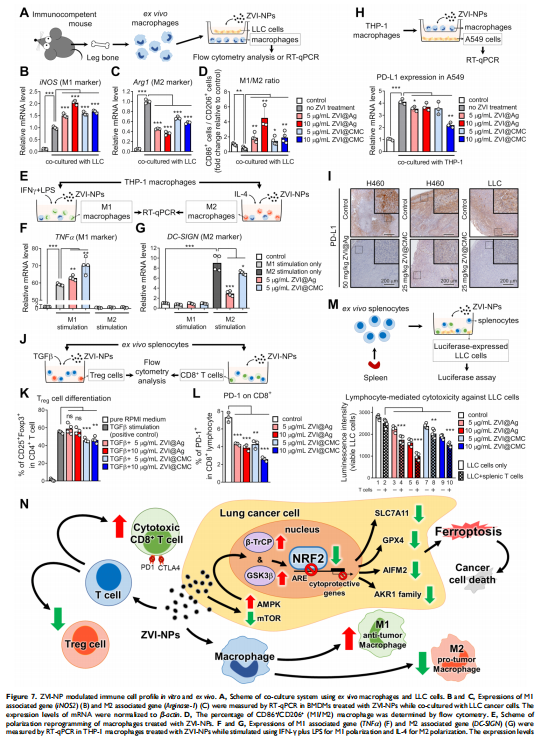
<图7>
结论:
总之,这项研究确定了 ZVI-NP抗癌活性的双重机制,可以避免非恶性细胞。第一种机制涉及通过激活AMPK/mTOR信号通路增强GSK3β/β-TrCP依赖性 NRF2降解,从而选择性地触发肺癌细胞中的铁死亡。第二种机制是通过激活抗肿瘤免疫反应。它涉及调节巨噬细胞向抗肿瘤M1表型极化和增强CD8 +的细胞溶解活性淋巴细胞以及降低 Treg 细胞的比例。通过对分子机制的理解,我们提出 NRF2 或相关蛋白可以作为肺癌或 NRF2 成瘾癌症患者的生物标志物,这些患者可能受益于 ZVI-NP 治疗。此外,具有生物相容性涂层和可大规模生产的 ZVI@CMC 可能会发挥新的晚期癌症治疗的潜力。这些结果为开发可协同靶向癌细胞和肿瘤微环境的新型抗癌精准纳米药物提供了见解。

