摘要
程序性细胞死亡1(PD-1)在三阴性乳腺癌(TNBC)的肿瘤浸润淋巴细胞(TIL)中广泛表达。作为主要的抑制性免疫检查点(ICP)受体,众所周知,细胞表面PD-1在细胞-细胞接触期间转导效应T细胞活性的负信号。然而,尽管有充分证明的抑制作用,但TIL中较高的PD-1表达与TNBC患者的更长生存期显着相关。这种现象提出了一个有趣的问题,PD-1是否具有增强抗肿瘤免疫的积极活性。在这里,我们表明PD-1由活化的T细胞以外泌体形式分泌,并且可以与细胞表面或外泌体程序性死亡配体1(PD-L1)远程相互作用,通过网格蛋白介导的内吞作用诱导PD-L1内化,从而防止随后的细胞PD-L1:PD-1相互作用,通过减弱PD-L1诱导的对肿瘤特异性细胞毒性T细胞活性的抑制来恢复肿瘤监视。我们的结果,通过揭示外泌体PD-1的抗PD-L1功能,为增强细胞毒性T细胞活性提供了积极的作用,并提供了一种潜在的治疗策略,即用膜结合抑制性ICP受体修饰外泌体表面以减弱抑制性肿瘤免疫微环境。

介绍
三阴性乳腺癌(TNBC)是一组高度异质性的肿瘤,具有多种生物学行为和临床结果。研究表明,33%的非炎症性TNBC病例具有免疫调节特征,并且在基底样亚型中,具有这种特征的病例频率最高(48%)。在TNBC肿瘤中,21.9%包含超过50%的肿瘤浸润淋巴细胞(TIL),并且所有病例中淋巴细胞浸润百分比的中位数约为20%。尽管TNBC基因组亚型的分类不统一,但被提议作为免疫调节特征标志物的高比例TIL与良好的预后密切相关。
程序性细胞死亡1(PD-1)是一种共抑制性免疫检查点(ICP)受体,可在T细胞活化后诱导,并在TIL中广泛表达(70.3%)。通过与程序性死亡配体1(PD-L1、CD274)的相互作用,转导效应T细胞活性的负信号,PD-1充当了肿瘤细胞通过逃避T细胞杀伤而存活的介质。然而,有趣的是,PD-1表达与TNBC患者更长的无病生存期和总生存期显着相关。一致的结果表明,高PDCD1TNBC肿瘤内的基因转录水平和大量PD-1阳性免疫浸润与显着增加的无病生存相关。总之,这些发现提出了一个有趣的问题:除了传统的免疫抑制活性之外,T细胞上的PD-1是否可能以某种方式与限制肿瘤细胞免疫逃避的可能功能相关联?
肿瘤免疫微环境是一个包含不同成分之间复杂系统网络的环境,包括由多种类型的细胞转运介导的细胞间通讯。外泌体是直径为30-200nm的单膜分泌性细胞外囊泡(EV),源自血浆和内体。根据它们的细胞来源,外泌体富含多种内容,并广泛参与肿瘤内的细胞间通讯。
源自T淋巴细胞的外泌体参与免疫反应的调节。根据细胞分类和状态,肿瘤相关T细胞分泌的外泌体的功能可能多种多样且复杂。在这项研究中,我们发现以外泌体形式分泌的PD-1可以防止TNBC中由PD-L1诱导的抗肿瘤免疫功能障碍,因此为治疗性外泌体的表面修饰提供了潜在的应用。
方法与结果
本研究首先分离了源自外周血单核细胞(PBMC)的T细胞和Jurkat-T细胞的外泌体。结果显示,携带膜结合PD-1的外泌体由活化的T细胞释放(见图一);实验结果进一步显示,Exo-PD-1增强T细胞介导的癌细胞杀伤(见图二)。接下来,为了验证Exo-PD-1通过与细胞表面PD-L1的相互作用减轻肿瘤细胞诱导的T细胞功能障碍,实验结果显示,Exo-PD-1竞争性占据PD-L1并减轻随后的T细胞功能障碍(见图三)。此外,又研究了Exo-PD-1与肿瘤细胞表面PD-L1结合的结果,有趣的是,作者发现Exo-PD-1通过网格蛋白介导的内吞作用诱导PD-L1内化(见图四)。之前的一项研究表明,不同细胞来源的外泌体可以相互物理相互作用以减弱随后的信号传导。本研究进一步发现:Exo-PD-1与Exo-PD-L1形成外泌体簇并挽救T细胞活性(见图五)。为了在体内验证Exo-PD-1的抗肿瘤功能,本研究建立了荷瘤小鼠模型,研究发现,Exo-PD-1抑制肿瘤生长并增强抗肿瘤免疫(见图六)。
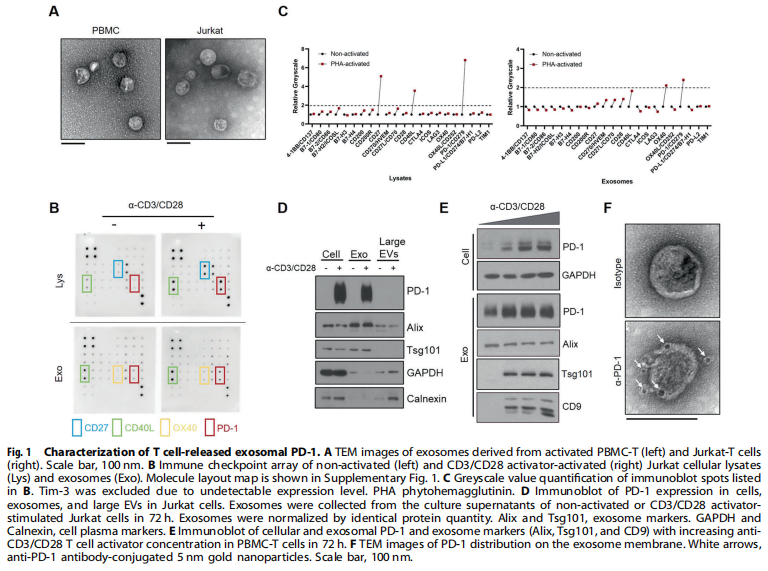
<图1>
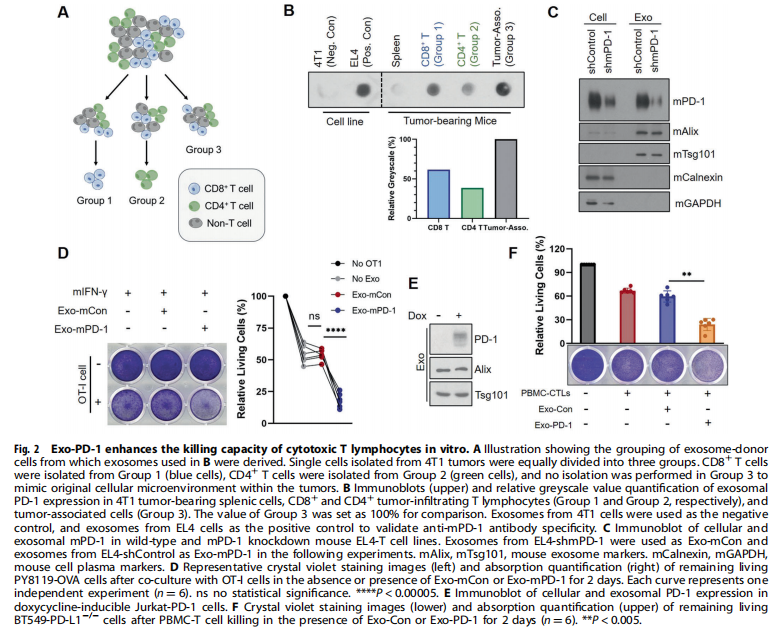
<图2>
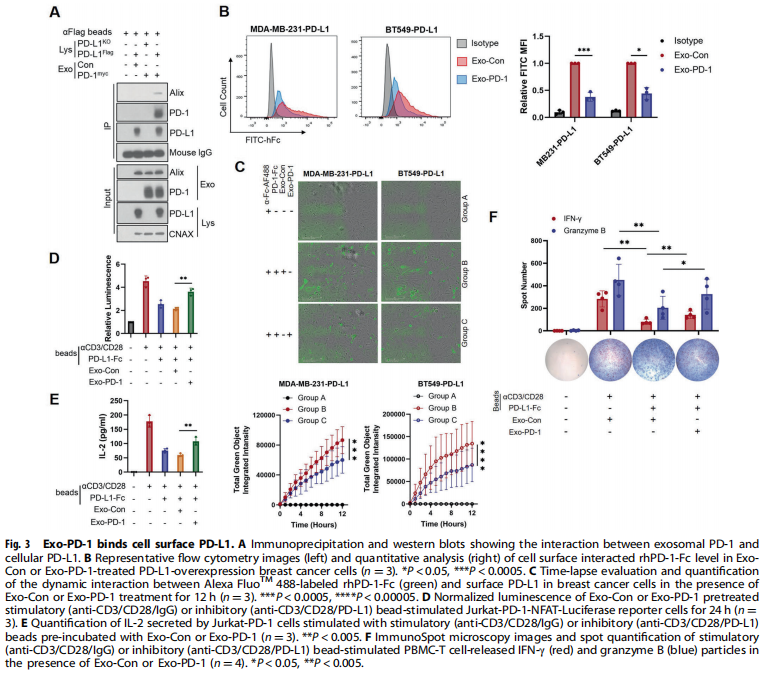
<图3>
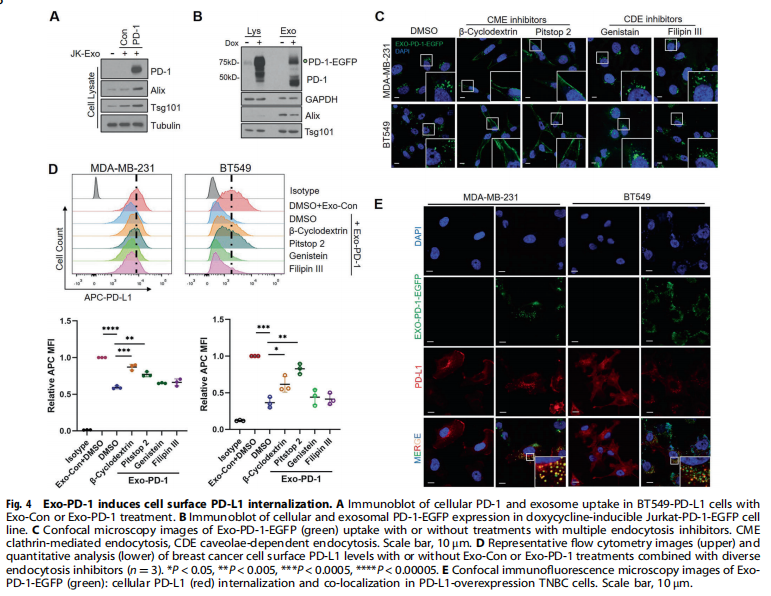
<图4>
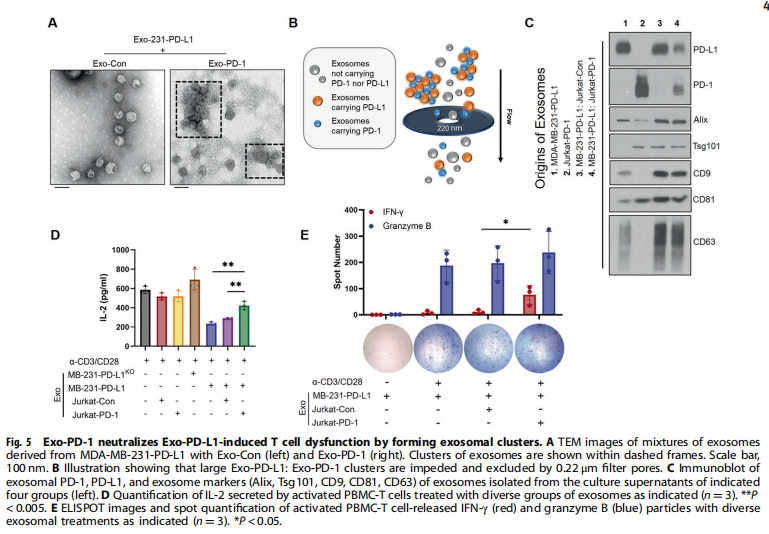
<图5>
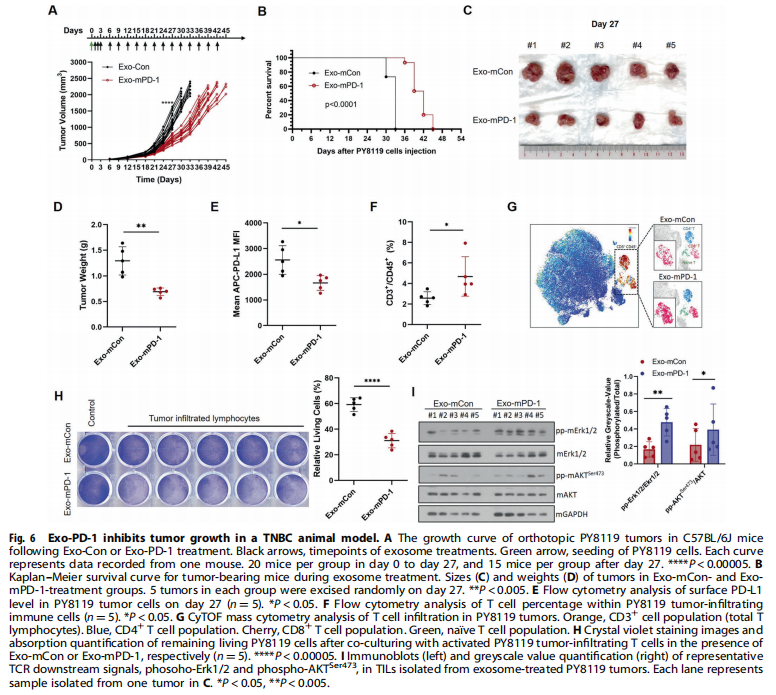
<图6>
讨论
免疫检查点在肿瘤免疫监视中发挥重要的调节作用。其中,PD-1在活化的肿瘤相关效应T淋巴细胞中广泛表达,目前被认为是抗肿瘤适应性免疫中的主要抑制调节因子。然而,PD-1的免疫抑制作用似乎与其临床意义相矛盾。对TNBC和其他癌症类型的研究表明,TIL中的PD-1表达与更好的临床结果之间呈正相关,尤其是在PD-1+CD8+T细胞群中。这种冲突目前部分由PD-1表达所指示的TIL激活来解释,但尚未报道PD-1分子在任何情况下是否在抗肿瘤免疫中发挥积极作用。在这项研究中,作者首先发现了源自活化T细胞的外泌体PD-1在防御PD-L1诱导的肿瘤逃避方面的生物功能(见图7)。除PD-1外,高比例的TIL表达其他ICP受体,这些受体可传递抑制性信号以促进T细胞活化和存活,这也是激素受体阴性乳腺癌的一个独立的有利预后因素。这些T细胞凋亡和衰竭的标志物是否由T细胞来源的外泌体携带,以及它们在肿瘤免疫中是否具有与外泌体PD-1相似的免疫功能,值得进一步研究。
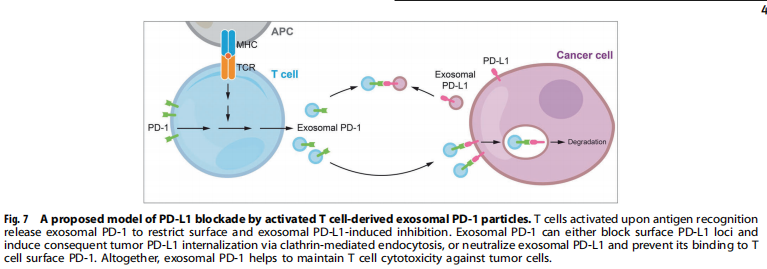
<图7>
作为细胞表面跨膜蛋白,PD-L1最初被认为仅在细胞与细胞的直接接触期间引起免疫抑制。然而,关于血清外泌体PD-1水平与癌症患者预后的相关性研究很少,血清外泌体PD-1作为生物标志物的预测价值在不同类型的癌症中仍存在争议。与血清外泌体PD-L1相比,血清外泌体PD-1水平可能无法代表肿瘤免疫微环境的真实状态。不像癌外来体的连续分泌,T细胞的外来体的传送强烈触发并从T淋巴细胞通过快速免疫突触受体细胞活化过程中严格定向。因此,在血液和体液中单独检测外泌体PD-1可能很困难且不可靠。尽管如此,鉴于其对PD-L1的生物功能,外泌体PD-1与其他外泌体ICP受体合作,仍有可能在未来的临床样本研究中作为一组综合性肿瘤预后标志物之一。
目前,EVs作为很有前途的药物和核酸载体正在研究中。外泌体作为一种纳米级的传递系统,基于其天然的生物膜结构,具有独特的特性。因此,外泌体膜的修饰与内部货物的修饰一样重要。根据本研究对外泌体PD-1的发现,作者还提供了一种基于治疗性肿瘤靶向外泌体的潜在细胞表面修饰的策略。效应T细胞表达的抑制性ICP受体目前被证明为免疫抑制因子。然而,基于目前的研究,发现新的方法将这些表面抑制性ICPs转移到可释放的外泌体形式,或直接刺激T细胞外泌体-icp抑制受体的极化和分泌,这将是合理的。此外,外泌体与化疗药物或核酸物质结合,装载表面抑制性ICP受体,如PD-1、Tim-3和lag3,可能能够减弱细胞外的免疫抑制微环境,同时攻击细胞内的肿瘤细胞。
文章出自:细胞实验 想了解更多请关注:http://www.do-gene.cn/



