摘要:
精神分裂症的早期检测和干预需要基于机制的生物标志物来捕获神经回路功能障碍,允许更好的患者分层、监测疾病进展和治疗。在氧化还原异常小鼠(Gclm-KO±GBR)的前额叶皮质和血液中,氧化应激诱导miR-137上调,导致COX6A2和线粒体吞噬标志物(NIX、Fundc1和LC3B)降低,受损线粒体积累,进一步加剧氧化应激和小白蛋白中间神经元(PVI)损伤。MitoQ是一种线粒体靶向的抗氧化剂,它挽救了所有这些过程。转化为早期精神病患者(EPP),血液外泌体miR-137增加和COX6A2减少,结合线粒体自噬标志物的改变,表明在动物模型的中心和外周观察反映在患者的血液中。较高的外泌体miR-137和较低的COX6A2水平与脑电图中ASSR伽马振荡的减少相关。由于ASSR需要适当的PVI相关网络,miR-137/COX6A2血浆外泌体水平的改变可能是PVI皮质微电路损伤的一个代理标志。EPP可分为两个亚组:(a)是线粒体功能障碍“Psy-D”患者组,外泌体中miR-137和COX6A2水平低,(b)是“Psy-ND”无线粒体损伤亚组,包括对照组中miR-137和COX6A2水平的患者。Psy-D患者表现出更多的ASSR反应受损,与更差的精神病理状态、神经认知表现、整体和社会功能相关,这表明PVI线粒体损伤导致更严重的疾病。这种分层将允许以高选择性和特异性选择患者进行针对脑线粒体失调的治疗,并捕获未来临床试验的临床和功能疗效。

介绍
精神分裂症(SZ)中最持久的观察结果之一是皮质小清蛋白中间神经元(PVI)[1]的功能障碍。该GABA能细胞子集凭借其在皮质网络内的高放电率控制锥体神经元集合的精确同步活动,从而调节伽马频率节律及其认知相关性。据报道,PVI中的缺陷是导致神经同步中断和随后在SZ中通常观察到的认知行为过程破碎的基础。为了维持驱动PVI的高放电率和节律性所需的大量能量需求,这些细胞具有高线粒体含量,这使他们更容易受到氧化应激(OxS)。越来越多的证据表明SZ中存在线粒体功能障碍,这表现为电子传递链活动的丧失和无氧活动的转变。然而,允许从动物模型转化为患者的精确分子和细胞机制仍然缺失。此外,需要基于机制的血液生物标志物介导特定的行为和认知改变,以便在治疗和预防方面对患者进行分层。
最近的研究指出OxS是SZ病理生理学的一个“中心枢纽”,来自环境和遗传研究的汇聚证据将这一过程与PVI损伤联系起来:实际上,在携带遗传和/或环境风险的一系列动物模型中,我们表明PVI缺陷都伴随着前额叶皮层的氧化应激。OxS可能是由SZ中通常受影响的系统失调引起的,包括谷氨酸能、多巴胺能、免疫和抗氧化信号。作为收敛终点,氧化还原失调已成功地通过多种动物模型通过抗氧化剂/氧化还原调节剂保护PVI。更重要的是,抗氧化剂和谷胱甘肽前体NAC在改善早期精神病患者的认知方面取得了可喜的成果。
在这里,本研究使用Gclm-KO模型研究了氧化还原失调对PVI线粒体自噬缺陷的影响。使用前扣带回皮层(ACC)中OxS、PVI和线粒体自噬的标记的定量评估来检查OxS的作用,ACC是一个已知受到影响并在SZ中显示氧化还原失调的前额叶区域。作者随后研究了氧化还原失调对miR-137表达的影响,因为它参与了线粒体自噬调节以及与SZ遗传相关的有力证据。作者还研究了细胞色素c氧化酶亚基VIa多肽2(COX6A2),细胞色素c氧化酶复合物IV(COX-IV)的亚基,线粒体呼吸链中的末端酶。事实上,主要与线粒体基因表达失调有关的COX功能改变是脑组织线粒体功能障碍的基础。
本研究接下来探讨了用甲磺酸米托醌(MitoQ)进行的线粒体靶向抗氧化治疗是否可以恢复PVI完整性和线粒体自噬缺陷。最后,通过采用反向转化方法,作者试图验证我们在精神病早期(EPP)患者队列中的临床前观察结果,以确定受干扰的线粒体自噬可能影响PVI介导的伽马振荡的潜在机制途径,如通过评估EEG中的听觉稳态反应(ASSR),与认知表现密切相关。
方法与结果
本研究用GBR(Gclm-KO+GBR)对Gclm-KO小鼠进行药理学攻击。实验结果显示,通过氧化应激在Gclm-KO小鼠的ACC中引发线粒体自噬(见图1A),改变与Gclm-KO小鼠ACC中PVI完整性相关的miR-137表达,Gclm-KO小鼠血浆miR-137水平升高(见图1B),COX6A2和PV的大脑特异性共定位(见图1C)。MitoQ治疗可挽救氧化应激诱导的miR-137、COX6A2、线粒体自噬和PVI改变(见图1C);miR-137抑制剂注射挽救Gclm-KO+GBR动物ACC中的COX6A2、PVI和8-oxo-DG染色(见图1C)。然后,我们评估了 EPP 队列中血浆 miR-137、COX6A2 和线粒体自噬标记物水平,研究结果表明,逆向翻译:早期精神病患者血浆外泌体miR-137、线粒体自噬标志物和COX6A2水平的改变(见图2A);早期精神病患者的伽马波段听觉稳态反应(ASSR)改变(见图2B);早期精神病患者中miR-137和COX6A2外泌体水平与听觉稳态反应(ASSR)之间的关联(见图2C)。
进一步研究发现,COX6A2和miR-137的结合外泌体水平允许患者在有或没有线粒体功能障碍的亚组中分层(见图3A);ASSR受损和氧化还原系统失调与具有线粒体功能障碍的EPP亚组有关(见图3B)。为了探索与基于miR-137和COX6A2的组合分层(即Psy-D和Psy-ND亚组)相关的不同精神病理学和神经认知特征的可能性,我们评估了患者和对照组的认知功能和临床症状组。实验结果表明,具有线粒体功能障碍的EPP亚组中更严重的临床症状和认知缺陷(见图4)。
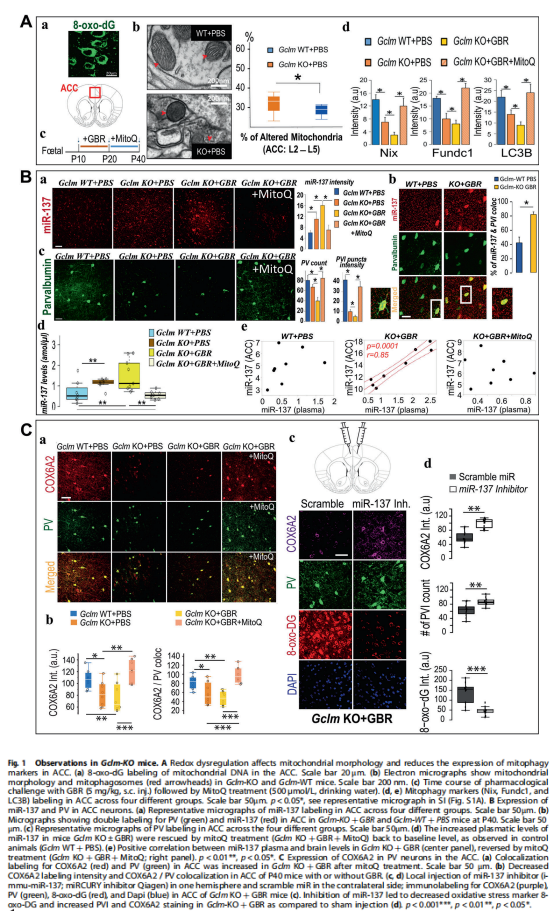
(图1)
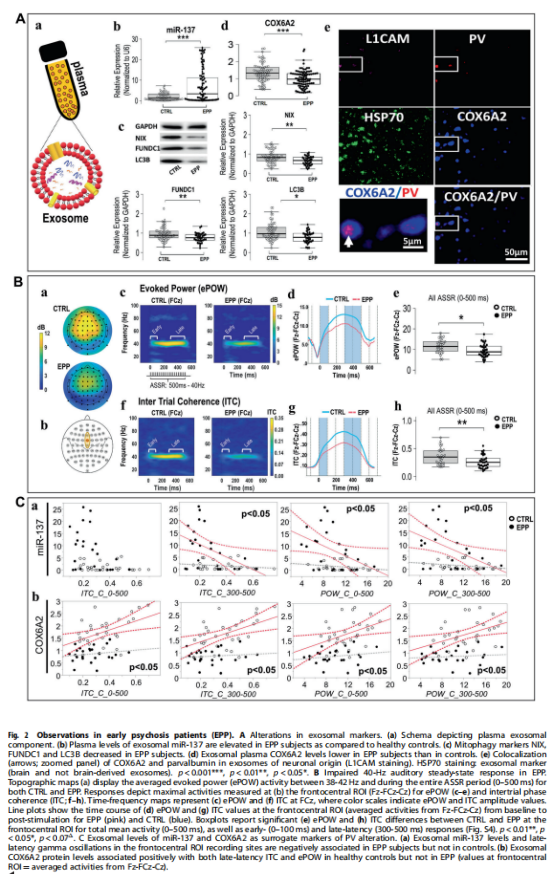
(图2)
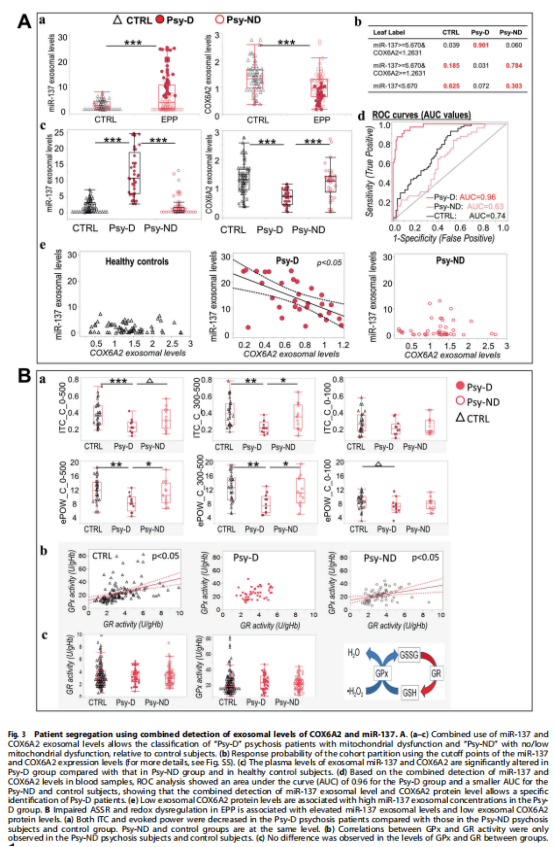
(图3)
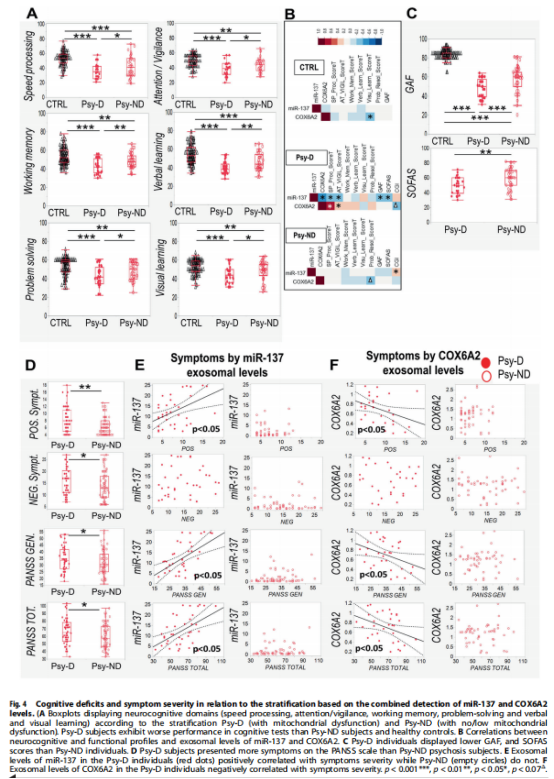
(图4)
结论
氧化应激被认为是SZ的主要病理特征。本研究发现允许将EPP分为两个亚组:(a)“Psy-D”亚组,其特征在于外泌体中高miR-137和低COX6A2水平,大概代表PVI中功能失调的线粒体,以及(b)“Psy-ND””亚组,包括具有与对照组相同范围内的miR-137和COX6A2水平的患者。Psy-D患者表现出更多受损的ASSR反应,与更差的精神病理学状态、神经认知表现以及整体和社会功能相关,这表明PVI线粒体受损将导致更严重的疾病特征(参见总结图5)。
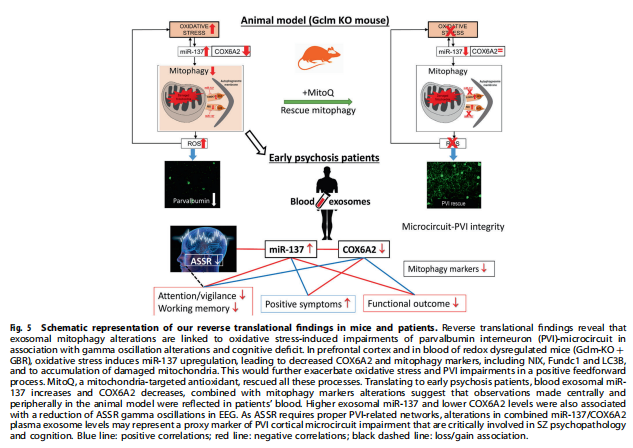
(图5)
在这里,作者提供了临床前证据,表明OxS诱导显着和特定的miR-137升高与COX6A2降低相关,与小清蛋白共定位于前额叶PVI细胞体以及包括棘和末端在内的过程中。有趣的是,COX6A2在高度活跃的心肌和骨骼肌中选择性表达[38],其在快速升高的PVI中的表达与其强烈的氧化代谢一致。
本研究首次强调了外泌体miR-137和COX6A2作为两种新型生物标志物的组合特征,最有可能在血浆中反映PVI线粒体的状态。这允许区分患者的两个亚组:Psy-D组,具有高miR-137和低COX6A2水平,以及Psy-ND组,其miR-137和COX6A2水平与对照值相似。特别是,PANSS评分与miR-137水平呈正相关,与COX6A2水平呈负相关,表明标志物水平与症状严重程度之间存在直接关系。尽管不能排除其他未评估因素对最严重症状患者的这种关联的潜在贡献,但我们的结果强调,PVI微电路的损伤会导致更严重的疾病表型。
本研究有一个值得注意的局限性。EPP组中的大多数人正在接受抗精神病治疗;然而,这种治疗很少,因为他们是在精神病的早期阶段招募的。需要对更多未接受药物治疗的患者进行更多研究,以验证和扩展当前的发现。
综上所述,本研究结果揭示了病理生理学、基于机制、可靠的生物标志物,导致选择同质的患者亚组和客观措施,以捕捉新药试验中的临床疗效。从转化的角度来看,未来的分层临床试验评估线粒体靶向抗氧化剂在生物标志物指导的精神病和SZ治疗中的作用是有必要的。鉴于线粒体靶向抗氧化剂的安全性,我们的研究结果为在个体水平上为非常异质的“临床高风险”或“处于危险的精神状态”受试者提供急需的精确诊断和早期治疗铺平了道路。
除了精神病和SZ之外,所提出的基于机制的生物标志物谱可能导致线粒体靶向抗氧化剂的分层临床试验,也可应用于其他脑部疾病。事实上,OxS和线粒体损伤、兴奋-抑制平衡、神经同步和认知与其他主要的精神和神经疾病有关,包括自闭症、双相情感障碍、情绪障碍、焦虑症紊乱,癫痫,与年龄相关的疾病,和认知功能障碍。

