摘要:
巨噬细胞是破骨细胞的祖细胞,也是骨代谢的调节剂。巨噬细胞不仅在生理条件下介导成骨细胞的骨形成,而且还介导骨折后的骨再生。然而,巨噬细胞调节骨形成和再生的机制仍不清楚。在这里,作者证明脂质体包裹的氯膦酸盐(Clod-lip)注射小鼠模型具有由钻孔损伤和吞噬性巨噬细胞的靶向消耗引起的皮质骨缺损,显示出结合血管生成和成骨的H型血管的血管生成受损。此外,还确定了Tgfbi(编码TGFBI)、Plau(编码uPA)和Tgfb1(编码TGF-β1),通过RNA-seq分析,作为介导血管生成和伤口愈合的巨噬细胞分泌因子的基因。通过qRT-PCR确定,相关mRNA在骨细胞中的骨髓源巨噬细胞中高度表达。最后,公开了用uPA抑制剂或TGF-β受体I、受体II抑制剂治疗损伤后会损害骨再生,证实了uPA和TGF-β1在骨再生过程中的重要性。我们的研究结果揭示了一种由巨噬细胞介导的骨再生的新机制。

介绍
巨噬细胞,主要称为免疫细胞,在生理条件下介导骨代谢。巨噬细胞从造血干细胞分化而来,吞噬非自身,如细菌,并将抗原暴露给T淋巴细胞,从而充当生物防御的基石。通过多种方法消耗巨噬细胞,例如巨噬细胞Fas诱导的细胞凋亡(MaFIA)小鼠模型、CD169-白喉毒素受体(DTR)小鼠模型和注射脂质体包裹的氯膦酸盐(Clod-lip),导致骨形成严重减少,表明巨噬细胞不仅作为吞噬细胞,而且作为成骨细胞骨合成代谢作用的直接或间接支持者。然而,巨噬细胞介导骨形成的机制尚不完全清楚。
骨骼不断地被破骨细胞吸收并被成骨细胞再生,从而在生理条件下产生新骨。骨折后的骨再生通常也很快发生,但延迟愈合或不愈合可能会在大约5-10%的骨折患者中发生。阐明骨修复的细胞和分子机制被认为对骨再生医学的发展有很大贡献。虽然也有人提出巨噬细胞参与骨损伤后的骨再生,其机制未知。在这项工作中,表明巨噬细胞的消耗表现出骨损伤后H型血管形成和骨再生受损,并确定Plau(编码uPA)、Tgfb1(编码TGF-β1)和Tgfbi(编码TGFBI)是巨噬细胞衍生的通过RNA-seq分析骨再生过程中的血管生成和伤口愈合因素。此外,uPA抑制剂和TGF-β受体I、受体II抑制剂注射小鼠表现出骨再生受损。这些结果表明巨噬细胞衍生的uPA和TGF-β在骨再生过程中起重要作用。
方法与结果
为了确定巨噬细胞对骨再生的功能,我们在做实验外包时使用钻孔损伤的股骨皮质骨缺损模型和注射Clod-lip以消耗巨噬细胞。实验结果显示,巨噬细胞的消耗显示出骨再生受损(见图一);巨噬细胞的消耗在骨再生过程中表现出H型血管的血管生成受损(见图二)。鉴定在骨再生过程中介导血管生成和伤口愈合的巨噬细胞分泌因子(见图三、图四)。为了检查uPA和TGF-β1在骨再生过程中的功能,在骨损伤后将uPA抑制剂(盐酸阿米洛利)或TGF-β受体I、受体II抑制剂(LY-364947)注射到小鼠体内。研究结果进一步表明,uPA抑制剂或TGF-β受体I、受体II抑制剂注射小鼠表现出骨再生受损(见图五)。
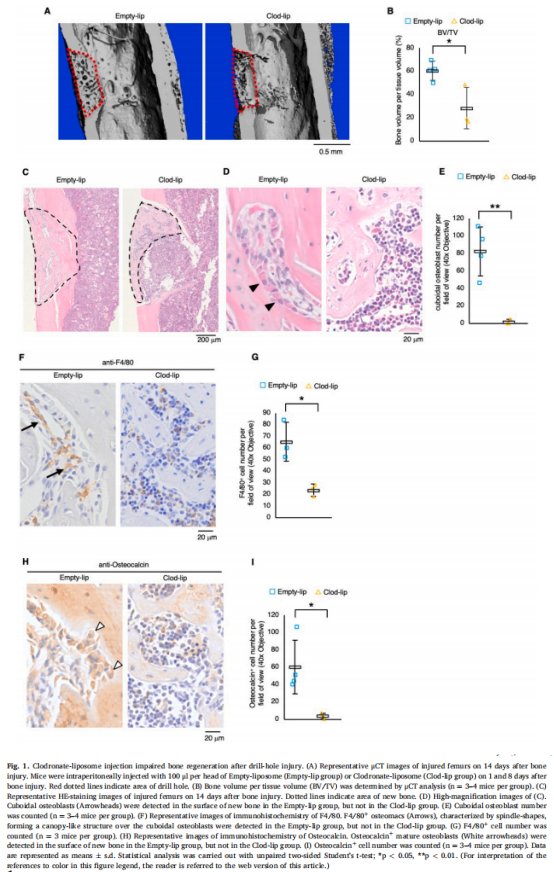
(图一)
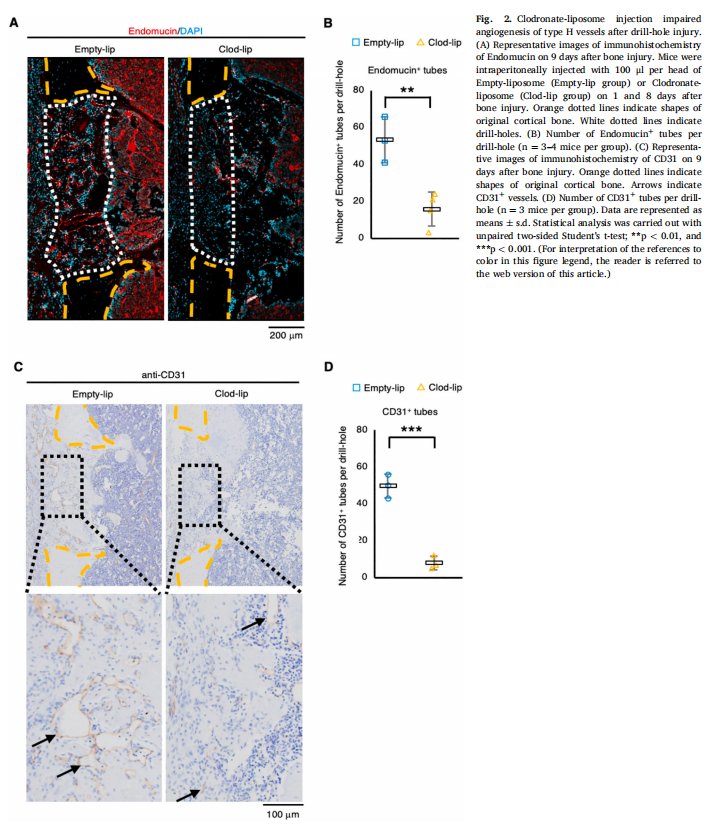
(图二)
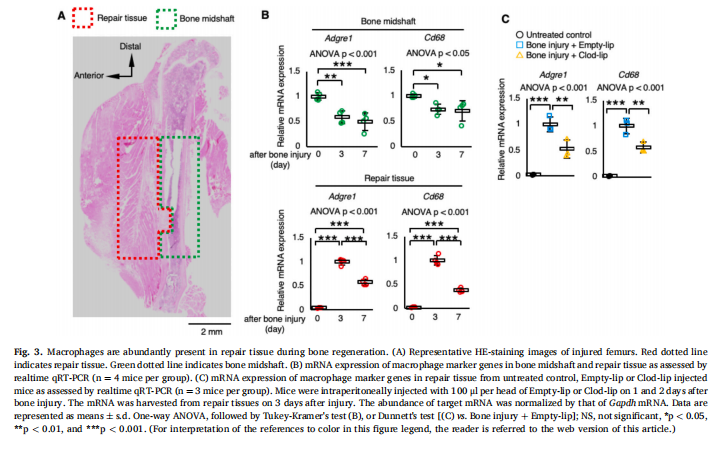
(图三)
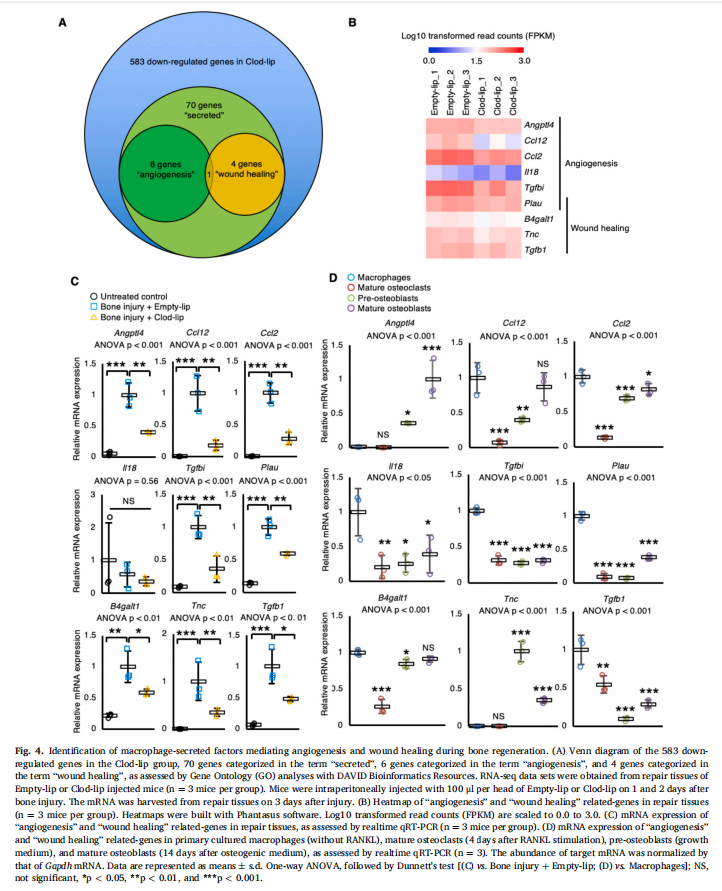
(图四)
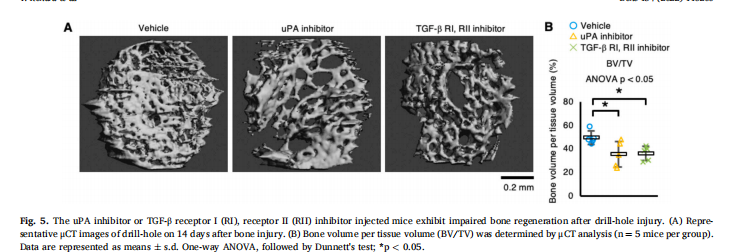
(图五)
结论
总之,这项研究表明巨噬细胞是小鼠骨再生过程中H型血管形成所必需的,并且它可能由巨噬细胞衍生的uPA和TGF-β1介导。我们的发现表明了一种由巨噬细胞介导的骨再生的新机制。
研究的局限性
虽然这项研究证实巨噬细胞高表达Plau、Tgfb1和TgfbimRNA,并且uPA和TGF-β1在骨再生中起着重要作用,但正如抑制剂注射实验所评估的那样,许多问题,例如TGFBI在骨再生中的功能在我们的实验中,这些抑制剂的特异性,以及uPA、TGF-β1、TGFBI和H型血管血管生成之间的机制关系仍有待解决。进一步研究使用巨噬细胞特异性条件基因敲除小鼠等等,将有必要解决这些问题。

