摘要:
前列腺素E2(PGE2)是一种主要的环氧合酶-2(COX-2)产物,由骨关节炎(OA)患者的软骨下骨组织中的成骨细胞谱系高度分泌。然而,非甾体抗炎药,包括COX-2抑制剂,在OA治疗期间具有严重的副作用。因此,迫切需要鉴定OA进展中PGE2信号传导的新药物靶点。破骨细胞在软骨下骨稳态和OA相关疼痛中起关键作用。然而,PGE2调节破骨细胞功能和随后的软骨下骨稳态的机制在很大程度上是未知的。在这里,本文显示PGE2在OA和OA相关疼痛的进展过程中通过破骨细胞上的EP4受体起作用。本文的数据表明,虽然PGE2通过其EP2和EP4受体介导迁移和破骨细胞生成,EP4LysM减少了OA小鼠模型中的疾病进展和骨赘形成。此外,与OA相关的疼痛在EP4LysM小鼠中得到缓解,Netrin-1分泌减少和软骨下骨的CGRP阳性感觉神经支配。EP4LysM小鼠中血小板衍生生长因子-BB(PDGF-BB)的表达也较低,这导致软骨下骨中H型血管的形成减少。重要的是,本文发现了一种新型强效EP4拮抗剂HL-43,其在体外和体内的作用与在EP4LysM中观察到的一致。最后,作者发现Gαs/PI3K/AKT/MAPK信号通路是破骨细胞中通过PGE2激活EP4的下游。总之,本文的数据表明破骨细胞中的PGE2/EP4信号传导介导软骨下骨中的血管生成和感觉神经元神经支配,促进OA进展和疼痛,并且用HL-43抑制EP4在OA中具有治疗潜力。

介绍
骨关节炎(OA)是一种高度流行的退行性关节疾病,影响全球超过3亿人。OA的病理生理学涉及整个关节,其特点是软骨和滑膜炎症、关节软骨退化、骨赘形成和软骨下骨硬化。目前的治疗策略主要旨在减轻症状,并且没有令人满意的药物或治疗方法可以预防或延缓OA进展。在晚期OA中,关节置换手术是提高患者生活质量的主要策略,具有显着的社会经济影响。因此,迫切需要更好地了解OA发病机制的潜在机制,以制定新的治疗策略。
OA的病因是多因素的,并且随着衰老、肥胖、关节创伤、机械负荷增加和遗传易感性的增加,发生该疾病的风险也会增加。最近,越来越多的证据支持软骨下骨稳态功能在OA的开始和进展中发挥作用。位于关节软骨下方的软骨下骨吸收、分配和传递关节所承受的机械载荷。然而,不稳定的机械负荷、肥胖和衰老使软骨下骨微结构变得更加硬化,重塑增加,骨囊肿发生频率更高,这可能先于软骨损伤。事实上,一些研究已经将软骨下骨的这些变化与软骨损伤和OA的严重程度增加联系起来。
前列腺素E2(PGE2)是一种重要的脂质介质,来源于环氧合酶(COX1-2)催化花生四烯酸。PGE2是体内最丰富的前列腺素,在生理条件下,它调节各种生物学功能,包括炎症、血压、生育能力和骨稳态。在OA中,COX-2表达和PGE2产生与受损的关节软骨有关,而不是与正常软骨有关,这表明其在疾病发病机制中的作用。事实上,在自发性OA小鼠模型中,骨细胞中COX-2的组织特异性敲除(消除了软骨下骨中PGE2的产生)减缓了疾病的进展。
PGE2通过四种E前列腺素(EP)视紫红质样G蛋白偶联受体(EP1-4)46发挥其复杂的生物学效应。EP2和EP4在骨骼系统中高度表达,尤其是EP4起着重要的调节作用。EP4敲除小鼠缺乏PGE2诱导的骨形成,这归因于成骨细胞分化减少。此外,EP4激动剂可减少去卵巢大鼠的骨质流失。在OA中,PGE2/EP4信号轴的作用仍然存在争议,研究报告了对蛋白多糖合成和基质降解的矛盾影响。此外,PGE2在OA中调节软骨下骨稳态,特别是破骨细胞功能的确切机制仍然很大程度上未知。
在这项研究中,作者研究了PGE2如何通过破骨细胞中的EP4受体而不是EP2受体发挥作用,可能在OA发病机制中发挥重要作用。此外,作者将HL-43鉴定为一种新的强效EP4拮抗剂,可能具有治疗OA的临床应用。
方法与结果
本文研究了PGE2如何通过破骨细胞中的EP4受体而不是EP2受体发挥作用。实验结果显示:来自骨关节炎的软骨下骨的破骨细胞中EP4而非EP2的表达升高(见图一);PGE2通过EP2和EP4调节迁移和破骨细胞分化(见图一);EP4缺失,但不是EP2缺失,抑制OA小鼠模型中的OA进展(见图二);破骨细胞中的EP4敲除通过抑制Netrin-1分泌和将CGRP阳性感觉神经元募集到软骨下骨来减轻OA的疼痛(见图三);破骨细胞中的EP4敲除通过抑制PDGF-BB分泌来减少软骨下骨中的H型血管(见图四)。研究结果进一步显示,鉴定一种用于PGE2诱导的迁移和破骨细胞分化的新型强效EP4拮抗剂(见图五);HL-43是一种EP4拮抗剂,可抑制OA小鼠模型中的OA进展(见图五);HL-43通过抑制Netrin-1分泌并将CGRP阳性感觉神经元募集到软骨下骨来减轻OA疼痛(见图六);HL-43通过抑制破骨细胞分泌PDGF-BB来减少软骨下骨中的H型血管与载体治疗组相比(见图七);PGE2/EP4信号轴通过Gαs/PI3K/AKT/MAPK激活调节迁移和破骨细胞分化(见图八)。
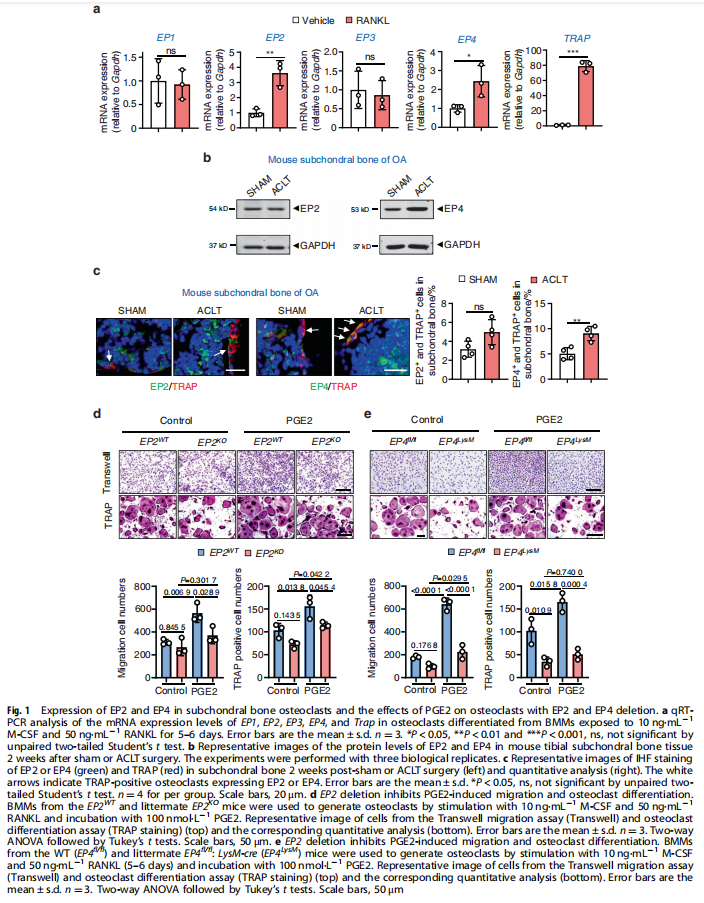
(图一)
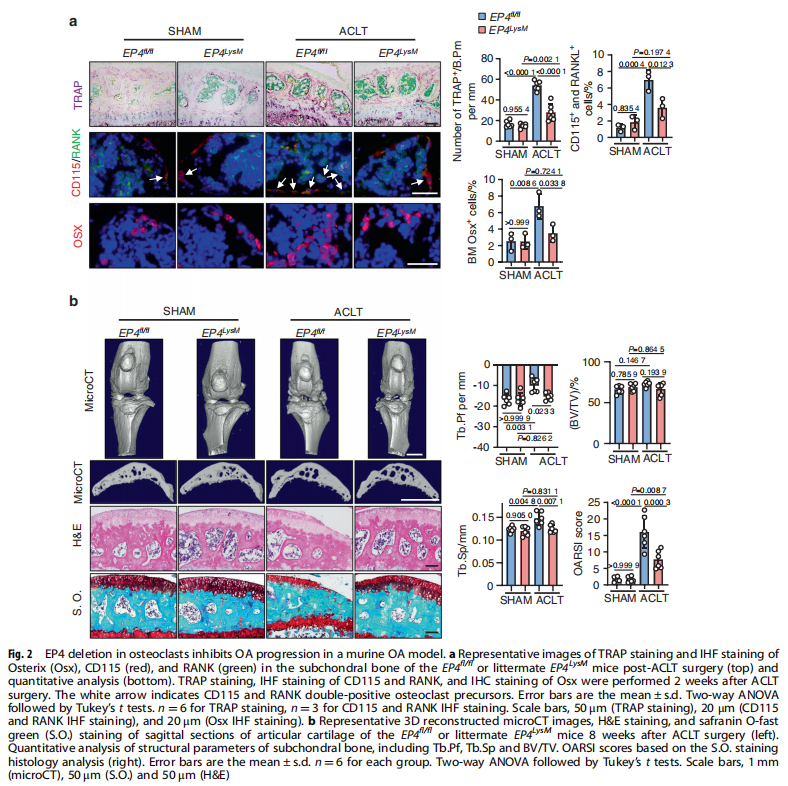
(图二)

(图三)
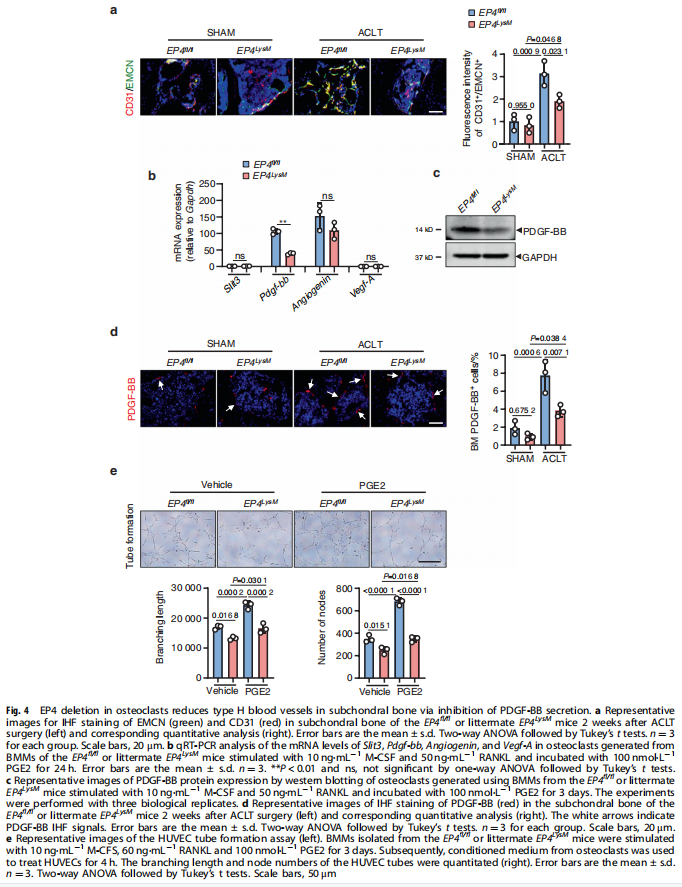
(图四)
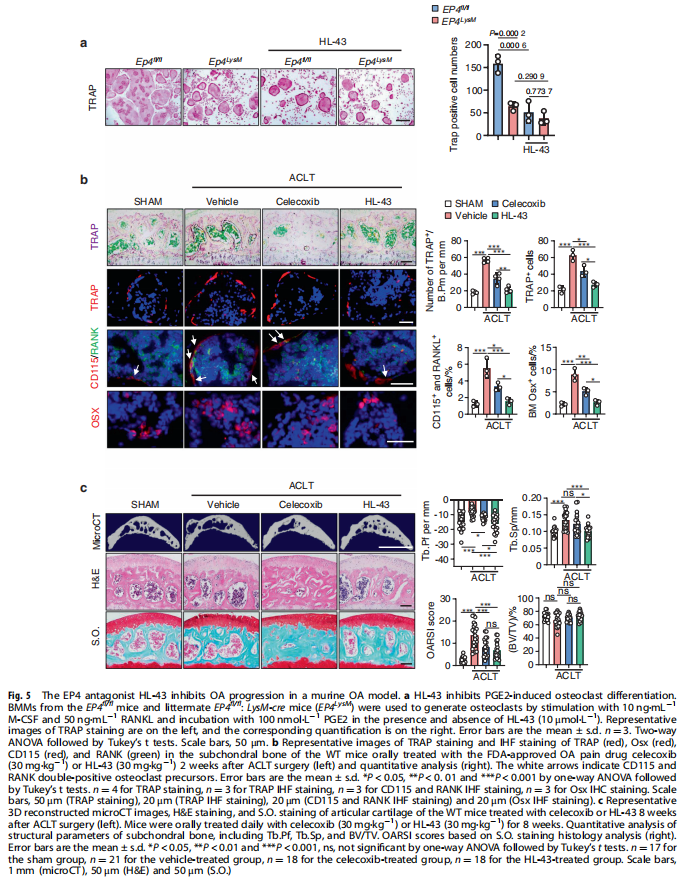
(图五)
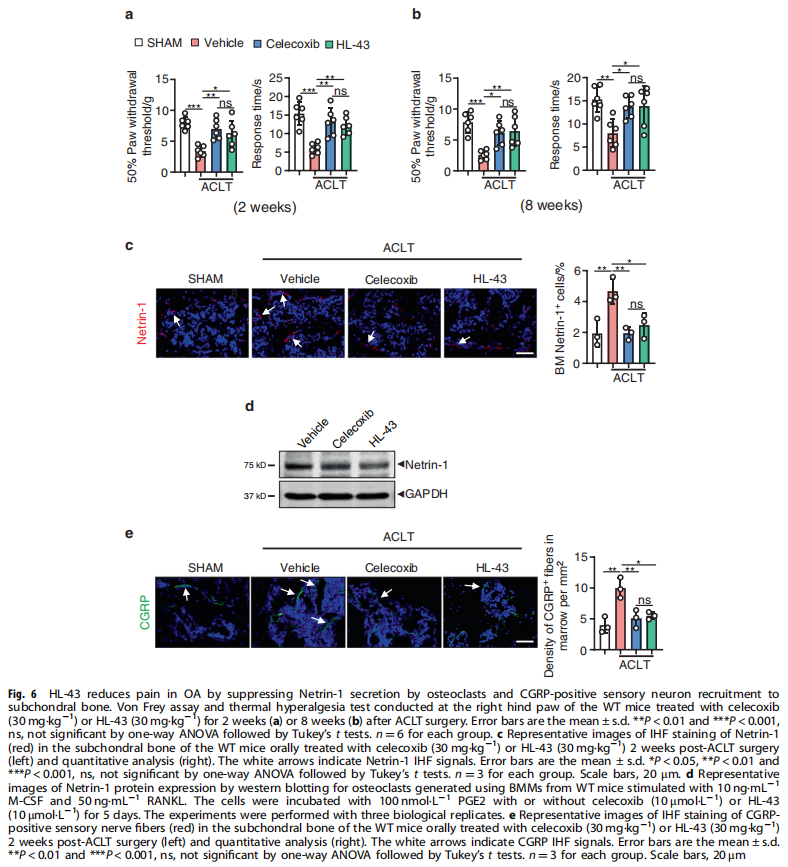
(图六)
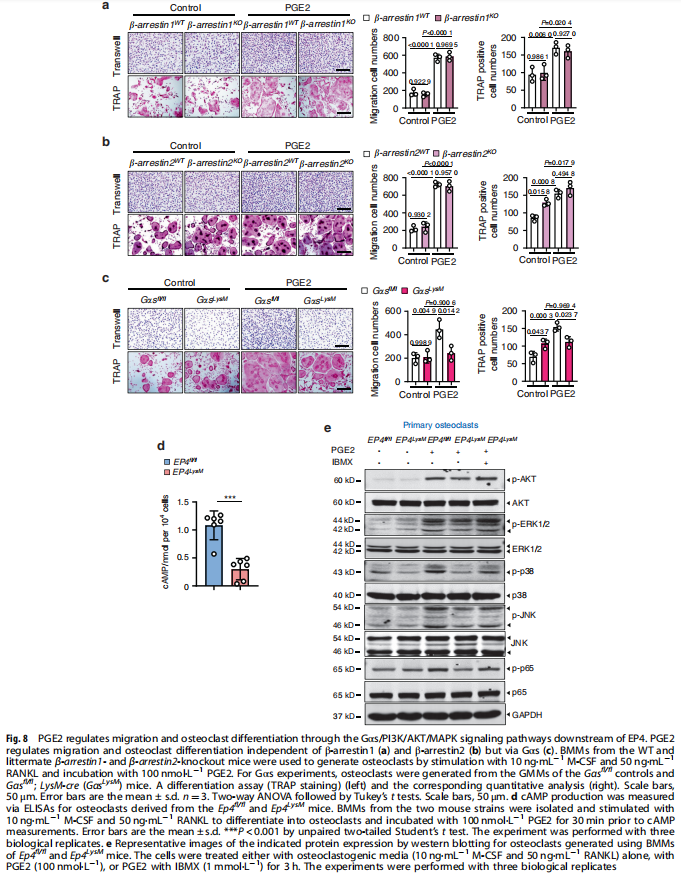
(图七)
结论
总之,本文的研究确定了PGE2作用于软骨下骨破骨细胞介导OA发病机制的新机制。我们提供的证据表明PGE2对破骨细胞的这些作用是通过EP4受体发生的。此外,靶向破骨细胞中的PGE2/EP4可显着减弱软骨下骨血管生成和感觉神经元神经支配,从而降低疼痛敏感性。最后,作者还确定HL-43是一种有效的EP4拮抗剂,它与EP4缺失相似,可减少OA进展、骨赘形成和疼痛敏感性,并改善软骨下骨微结构,因此是OA治疗的新候选者。
文章出自:细胞实验外包 想了解更多请关注:http://www.do-gene.cn/

